Первые упоминания о гемолитической болезни крови новорожденного датируются 1609 годом, записи об этом заболевании были найдены в трудах французских медиков. В начале ХХ века американские педиатры К. Блэкфэн и Л. Даймонд ввели понятие «неонатальный эритробластоз», характеризующее данную патологию. Но причины ГБПиН впервые были описаны только в 1941 году их соотечественником – иммуногематологом Ф. Левиным.
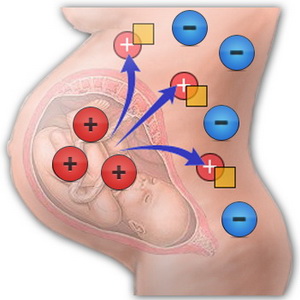
Гемолитическая болезнь плода и новорожденного (ГБПиН) — это изоиммунная гемолитическая анемия, возникающая при несовместимости крови матери и плода по эритроцитарным антигенам, когда антигеном являются эритроциты плода, а антитела вырабатываются в организме матери.
Причины и картина развития гемолитической болезни новорожденного и плода
Причиной гемолитической болезни новорожденного является резус-несовместимость родителей ребенка. Заболевание диагностируют приблизительно у 0,5 % всех новорожденных. В России в 2013 г. ГБПиН была диагностирована у 0,83% новорожденных. Известны 14 основных эритроцитарных групповых систем, объединяющих более 100 антигенов, а также многочисленные частные и общие с другими тканями эритроцитарные антигены. Эритроциты ребенка всегда имеют какие-то отцовские антигены, отсутствующие у матери. Вместе с тем ГБПиН обычно вызывает несовместимость плода и матери по резус- или АВО-системе, редко по другим антигенным системам ввиду их меньшей иммуногенности (Kell, Duffu, Kidd, S, M, Lewis).
Учитывая причину гемолитической болезни плода, основным повреждающим фактором является осложнение повышенного гемолиза — гипербилирубинемия с неконъюгированным билирубином. Тяжесть поражения плода зависит от повреждающего действия антител, их титра и длительности воздействия, проницаемости плаценты, реактивности плода и его компенсаторных возможностей.
Картина развития гемолитической болезни новорожденных и плода выглядит следующим образом. Антигенная резус-система состоит из 6 основных антигенов (синтез которых определяют 3 пары генов), обозначаемых либо С, с; D, d, Е, е (терминология Фишера), либо RhI, hrl; Rho, hro; Rhll, hrll (терминология Виннера). «Резус-положительные эритроциты» содержат D-фактор, а так называемые резус-отрицательные эритроциты его не имеют, хотя в них обязательно есть (за редчайшим исключением) другие антигены резус-системы, в частности d. Несовместимость по антигенам АВО-системы, приводящая к гемолитической болезни новорожденного (ГБН), обычно развивается при группе крови матери 0(1) и группе крови плода А(П) или В(Ш). Крайне редко ГБПиН развивается, если у матери А(Н), а у плода — В(Ш) или AB(IV) группа крови, а также при В(Ш) группе крови у матери и А(П) или AB(IV) — у ребенка.
Обычно при резус-конфликте дети с ГБН рождаются от 2-3-й беременности, реже от 1 -й — при сенсибилизации в прошлом переливаниями крови без учета резус-фактора. При АВ 0-несовместимости заболевание развивается у ребенка уже от 1-й беременности. Тяжесть состояния ребенка и риск развития ядерной желтухи при ГБН по АВ0-системе менее выражены по сравнению с ГБНиП по резус-фактору. Это объясняется тем, что групповые антигены А и В экспрессируются многими клетками организма, а не только эритроцитами, что приводит к связыванию значительного количества антител в некроветворных тканях и препятствует их гемолитическому воздействию.
При несовместимости крови матери и плода в организме беременной вырабатываются антитела, которые проникают через плаценту в кровь плода и вызывают разрушение его эритроцитов. Нормальная плацента здоровой женщины непроницаема для антител. Она становится проницаемой лишь при различных заболеваниях и патологических состояниях беременности, а также во время родов. При проникновении антител в плод во время беременности развитие гемолитической болезни новорожденного происходит внутриутробно.
Клиника гемолитической болезни новорожденных: классификация заболевания
Для формулировки клинического диагноза гемолитической болезни у новорожденного рекомендуется следующая классификация заболевания:
- В зависимости от вида иммунологической несовместимости эритроцитов матери и плода, являющегося причиной ГБН выделяют:
- несовместимость по резус-фактору;
- несовместимость по системе АВО (групповая несовместимость);
- несовместимость по редким факторам крови.
- По ведущим проявлениям клиники гемолитической болезни новорожденных:
- отечная форма (гемолитическая анемия с водянкой);
- желтушная форма (гемолитическая анемия с желтухой);
- анемическая форма (гемолитическая анемия без желтухи и водянки).
Отечная форма представляет собой наиболее тяжелую форму ГБНиП. Анемическая форма (для которой не характерны патологическая желтуха и водянка) чаще всего соответствует легкой степени тяжести ГБНиП. Желтушная форма может различаться по степени выраженности желтухи — от легкой до тяжелой степени.
- По наличию или отсутствию осложнений выделяют:
- осложненную форму (возможные осложнения: ядерная желтуха, синдром сгущения желчи, геморрагический синдром и другие состояния, требующие дополнительного патогенетического лечения);
- неосложненную форму.
Таблица «Патогенез гемолитической болезни плода и новорожденного: критерии степени тяжести»:
|
| Степень тяжести ГБН | ||
|
| I | II | III |
| Анемия (содержание гемоглобина в крови пуповины, г/л) | 150 | 150-100 | Менее 100 |
| Желтуха (содержание билирубина в крови пуповины, мкмоль/л) | 85,5 | 85,5-136,8 | 136,9 и более |
| Отечный синдром | Пастозность подкожной жировой основы | Пастозность подкожной жировой основы и асцит | Универсальный отек подкожной жировой основы |
Выделяют 3 клинические формы гемолитической болезни новорожденных: желтушную, анемическую, отечную. Тяжесть ГБН определяется совокупностью отечности, желтухи и анемии. Если основные симптомы относятся к ГБН I степени, то заболевание следует считать легким, если имеется хотя бы один из признаков II степени, то заболевание расценивается как среднетяжелое, даже при одном признаке III степени гемолитическая болезнь считается тяжелой.
Основные признаки желтушной формы гемолитической болезни плода и новорожденного
Желтушная форма гемолитической болезни новорожденных и плода — тяжелая и наиболее часто встречающаяся. Она развивается тогда, когда гемолиз начинается незадолго до родов и антитела воздействуют на достаточно зрелый плод, но их действие не слишком длительно и интенсивно, нет поломки приспособительных механизмов, декомпенсация не развивается и плод рождается живым. Рано появляется и интенсивно нарастает желтушное окрашивание кожи, увеличиваются печень и селезенка.
Симптомы анемии при этой форме гемолитической болезни новорожденных выражены умеренно. Ребенок обычно рождается в срок, с нормальной массой тела, без видимых изменений цвета кожи, но уже в 1-2-е сутки выявляется желтуха, которая быстро усиливается. Реже ребенок рождается с желтушной окраской кожи. Такую же окраску имеют околоплодные воды и первородная смазка. У всех детей с желтушной формой болезни содержание билирубина в пуповинной крови превышает 51 мкмоль/л (у здоровых новорожденных колеблется в пределах от 10,2 до 51 мкмоль/л, составляя в среднем 28,05 мкмоль/л по Ван дер Бергу).
Учитывая этиологию гемолитической болезни аллода и новорожденного, в последующие 72 ч у детей с ГБНиП уровень билирубина интенсивно нарастает по 3,5-17 мкмоль/(л • ч). Прирост уровня билирубина более 5,1 мкмоль/(л•ч) свидетельствует об интенсивном гемолизе.
По степени тяжести выделяют три варианта желтушной формы гемолитической болезни новорожденных и плода:
- Легкая — желтуха появляется к концу первых или началу вторых суток жизни, уровень билирубина в пуповинной крови не превышает 51 мкмоль/л, почасовой прирост билирубина — до 4-5 мкмоль/л, увеличение печени и селезенки умеренное (менее 2,5 и 1 см соответственно).
- Среднетяжелая — желтуха выявляется сразу или в первые часы после рождения, уровень билирубина в пуповинной крови превышает 68 мкмоль/л, почасовой прирост билирубина — до 6-10 мкмоль/л, увеличение печени — до 2,5-3 см и селезенки — до 1-1,5 см.
- Тяжелая — диагностируется внутриутробно по данным УЗИ плода и плаценты, показателям оптической плотности билирубина околоплодных вод, полученных при амниоцентезе, уровню гемоглобина (НЬ) и гематокрита (Ht), полученных при кордоцентезе. При несвоевременно начатом или неадекватном лечении желтушная форма может осложниться до ядерной желтухи.
В результате прироста билирубина через 24-48 ч появляются симптомы билирубиновой интоксикации: вялость, угнетение рефлекса сосания, патологическое зевание. Если уровень билирубина не снижается, то на 4-5-й день жизни появляются основные признаки «ядерной» желтушной формы гемолитической болезни новорожденных: судороги, глазодвигательные нарушения (симптом «заходящего солнца»), ригидность мышц затылка, опистотонус, «мозговой» крик, приступы цианоза и другие. Смерть от билирубиновой энцефалопатии может наступить через 36 ч после рождения, но наиболее часто это происходит на 3-и-5-е сутки. Критическим уровнем непрямого билирубина, при котором развивается ядерная желтуха, считается 342 мкмоль/л у доношенных и 256,5 мкмоль/л у недоношенных. Возникают нормобластоз, ретикулоцитоз. После уменьшения желтухи может выявляться гемолитическая анемия новорожденных.
Синдром холестаза — желтуха приобретает зеленоватый оттенок, печень несколько увеличивается в размерах.
Основные симптомы анемической и отечной форм гемолитической болезни новорожденного и плода
Анемическая форма гемолитической болезни новорожденных и плода возникает в результате непродолжительного воздействия небольшого количества изоантител в течение беременности или во время родов на развитый плод. Основными клиническими симптомами являются бледность кожных покровов (иногда с легкой иктеричностью), небольшое увеличение печени, реже селезенки. В крови наблюдаются снижение количества гемоглобина, эритроцитов и ретикулоцитов. Иногда признаки анемической формы признаки гемолитической болезни новорожденных очевидны при рождении, чаще анемия развивается стремительно на 2-й неделе жизни ребенка, в периферической крови регистрируется резкое снижение молодых форм эритроцитов. Уровень неконъюгированного билирубина невысокий. Последствий со стороны ЦНС при гемолитической анемии у детей, как правило, не отмечается.
Отечная форма гемолитической болезни новорожденных и плода наиболее тяжелая. Она возникает при длительном и интенсивном воздействии изоиммунных антител на недозрелый плод. Отечная форма обусловлена присутствием материнских Т-киллеров, проникающих к плоду и вызывающих реакцию трансплантат против хозяина, а также наличием материнских антител к тканям плода. В момент рождения часто выявляются желтушно окрашенные околоплодные воды, оболочки пуповины, первородная смазка. Наблюдаются такие признаки гемолитической болезни новорожденных и плода, как отек подкожной жировой основы, накопление жидкости в полостях (гидроторакс, асцит), расширение границ относительной сердечной тупости, приглушение тонов сердца, гепато- и спленомегалия.
Отсутствие желтухи при рождении связано с выведением непрямого билирубина плода через плаценту и его разведением в результате гиперволемии. Отмечаются гипопротеинемия (уровень белка сыворотки крови ниже 40-45 г/л), тяжелая форма анемии при гемолитической болезни новорожденных (НЬ = 35-50 г/л, количество эритроцитов 1,0-1,5 • 10\12/л), нормо-и эритробластоз. Большинство детей имеют низкую оценку по шкале АПГАР, в связи с наличием тяжелой дыхательной и сердечно-сосудистой недостаточности большинству из них требуется проведение комплекса первичных реанимационных мероприятий в родильном зале. Данная форма часто осложняется развитием ДВС-синдрома и шока.
Без раннего начала адекватной интенсивной терапии, включающей раннее проведение частичного обменного переливания крови, нарастание полиорганной недостаточности быстро приводит к смерти новорожденного.
В последние годы, в связи с широким внедрением в практическое акушерство, при раннем выявлении гемолитической болезни плода внутриутробных гемотрансфузий, частота встречаемости отечной формы ГБНиП несколько уменьшилась.
Ранняя диагностика гемолитической болезни новорожденного и плода
Ранняя диагностика гемолитической болезни новорожденных и плода заключается в правильной оценке анамнестических данных и проведении инструментального и лабораторного исследований. Предположение о ГБНиП может возникнуть при резус-отрицательном факторе крови у беременной и резус-положительном у ее мужа, указаниях в анамнезе матери на переливание крови без учета резус-фактора, при отягощенном акушерском анамнезе (выкидыши на поздних сроках, мертворождения, рождение ребенка с ГБН). В таких случаях при диагностике гемолитической болезни плода исследуют кровь беременной на резус-антитела.
На ГБН у новорожденного указывают раннее появление желтухи (в первые часы или сутки жизни), НЬ < 166 г/л, увеличение числа эритробластов и нормобластов (более 10 на 100 лейкоцитов), положительная проба Кумбса при резус-конфликте (при конфликте по системе АВО проба Кумбса отрицательная), содержание непрямого билирубина выше 51 мкмоль/л, снижение уровня белка в крови до 40-50 г/л.
Клинические рекомендации по терапии гемолитической болезни плода
Лечение гемолитической болезни плода (ГБП) направлено на снижение выраженности гемолиза и профилактику развития тяжелой анемии у плода. Все лечебно-профилактические методы разделяются на инвазивные и неинвазивные. С целью детоксикации, реокоррекции, иммунокоррекции проводят плазмаферез. Противопоказания к плазмаферезу: тяжелое поражение сердечно-сосудистой системы; анемия (НЬ < 100 г/л); гипопротеинемия (< 55 г/л); гипокоагуляция; иммунодефицитные состояния; аллергические реакции на белковые и коллоидные лекарственные средства, антикоагулянты.
Возможные осложнения у беременной при проведении плазма-фереза: аллергические реакции; анемия; нарушения электролитного состава крови; коллаптоидные состояния.
С целью ингибирования продукции собственных материнских антител и блокады Fc-связанных антител при плацентарном транспорте вводят иммуноглобулин человека нормальный — внутривенно по 0,4 г/кг массы матери, распределив дозу на 4-5 сут., каждые 3 нед. до родоразрешения.
При лечении используются инвазивные лечебно-профилактические методы терапии. Кордоцентез и внутриутробная трансфузия эритроцитной массы являются единственными патогенетическими методами лечения гемолитической болезни плода и проводятся только при резус-сенсибилизации.
Клинические рекомендации к проведению кордоцентеза при гемолитической болезни плода: отягощенный акушерский анамнез (гибель предыдущих детей от тяжелых форм ГБП и ГБН); наличие высокого титра антител (1:32 и выше); ультразвуковые признаки ГБП; высокие цифры оптической плотности билирубина в околоплодных водах, полученных при амниоцентезе (III зона шкалы Лили). Показанием к проведению внутриутробной трансфузии эритроцитной массы при выявлении у плода положительного резус-фактора является снижение показателей НЬ и Ht более чем на 15 % от гестационной нормы.
Сроки проведения — с 24-й по 35-ю неделю беременности.
Для внутриутробной трансфузии эритроцитной массы используют только отмытые эритроциты 0(1) группы крови — резус-отрицательные. Расчет необходимого объема трансфузии производят по формуле:
- V = (Нt3 – Ht1) / Ht2 х ПМП х V1,
- где V — необходимый объем трансфузии; Ht, — предоперационный Ht плода; Ht2 — Ht донорской крови; Ht3 — нормальный уровень Ht для данного гестационного возраста; ПМП — предполагаемая масса плода; V, — объем циркулирующей крови (ОЦК) плода для данного срока беременности.
Лечение гемолитической болезни новорожденного: фототерапия и ОЗПК
Лечение гемолитической болезни новорожденных включает: лечение гипербилирубинемии; коррекцию анемии; посиндромную терапию, направленную на восстановление функций различных органов и систем.
Лечение гипербилирубинемии начинают с консервативной терапии, а при критических цифрах билирубина ее сочетают с оперативной — заменным переливанием крови (ЗПК). Лечение гемолитической анемии у детей и легкой желтушной формы консервативное, при отечной форме, а также при тяжелой и среднетяжелой желтушной формах ее сочетают с ЗПК. В комплексное лечение ГБН включают фототерапию, инфузионную терапию, фенобарбитал (по показаниям). Выбор в пользу консервативной терапии или оперативного заменного переливания крови (ОЗПК) осуществляется на основании таблицы «Клинические рекомендации к проведению фототерапии и ОЗПК при гемолитической болезни новорожденного».
Показания к фототерапии и ОЗПК у новорожденных с диагнозом ГБН в возрасте 24—168 ч жизни в зависимости от массы тела при рождении (уровень общего билирубина в крови) приведены в таблице «Показания к проведению фототерапии и ОЗПК».
Таблица «Рекомендации к проведению фототерапии и ОЗПК при гемолитической болезни новорожденного:
| Масса тела при рождении в граммах | Фототерапия | ОЗПК |
| < 1500 | 85 мкмоль/л | 220 мкмоль/л |
| 1500-1999 | 140 мкмоль/л | 275 мкмоль/л |
| 2000-2500 | 190 мкмоль/л | 300 мкмоль/л |
| >2500 | 235 мкмоль/л | 340 мкмоль/л |
Показания к фототерапии: желтушность кожных покровов при рождении; уровень билирубина в пуповинной крови > 80 мкмоль/л; абсолютное значение уровня непрямого билирубина.
Таблица «Клинические рекомендации к проведению фототерапии при гемолитической болезни у детей»:
| Масса тела, г | Абсолютное значение уровня непрямого билирубина у новорожденных различного возраста, мкмоль/л | |||
| 24ч | 48ч | 72 ч | 4-7 сут | |
| < 1000 | 51 | 85 | 90 | 90-120 |
| 1000-1500 | 85 | 120 | 150 | 170 |
| 1500-2000 | 100 | 120 | 170 | 190 |
| 2000-2500 | 120 | 190 | 220 | 240 |
| >2500 | 130 | 200 | 220 | 250 |
Фототерапия (ФТ) — наиболее эффективный метод консервативной терапии. Возможно применение как стандартных ламп, так и фиброоптической и светодиодной (ФТ), целесообразно комбинировать несколько методов ФТ.
Принципы проведения фототерапии: следует соблюдать расстояние от источника до пациента, указанное в инструкции к аппарату; поместить ребенка в кувез; защитить глаза и половые органы; менять положение ребенка каждые 6 ч; доза облучения должна быть не менее 8 мкВт/ (см2 • нм); фототерапию проводят в непрерывном режиме круглосуточно, не менее 3-5 сут. Отменять фототерапию следует при снижении уровня непрямого билирубина <170 мкмоль/л. Спустя 12 ч после окончания фототерапии необходимо выполнить контрольное исследование билирубина. Фототерапия проводится до, во время (при помощи фиброоптической системы) и после операции заменного переливания крови.
Инфузионная терапия гемолитической болезни новорожденного
Инфузионная терапия – это метод лечения, основанный на введении в кровоток различных растворов определённого объёма и концентрации, с целью коррекции патологических потерь организма или их предотвращения.
С целью блокады Fc-рецепторов, вследствие чего становится невозможным взаимодействие антигена с антителом, что предотвращает гемолиз, внутривенно вводят иммуноглобулин.
Необходимо раннее начало введения: в первые 2 ч жизни (при антенатальной диагностике ГБН) или позже, но сразу при постановке диагноза. Используется иммуноглобулин человека нормальный — внутривенно в дозе 0,5-1 г/кг (в среднем 0,8 г/кг). Повторное введение иммуноглобулина при необходимости осуществляется через 12 ч от предыдущего. Введение иммуноглобулина при ГБН возможно в течение первых 3 суток жизни.
Операция заменного переливания крови в первую очередь направлена на удаление свободного (непрямого) билирубина, цель операции — предотвратить развитие ядерной желтухи при неэффективности консервативной терапии. Наиболее эффективное удаление билирубина из крови достигается при замене крови пациента на компоненты крови донора (эритроцитарная масса и плазма) в объеме 2 ОЦК.
До начала операции у новорожденных в тяжелом состоянии стандартными методами интенсивной терапии должны быть устранены ацидоз, гипоксемия, гипогликемия, электролитные нарушения, гемодинамические расстройства, гипотермия и т.д.

Различают раннее (первые двое суток жизни) и позднее (с третьих суток жизни) ЗПК.
Показания к раннему ЗПК на фоне проводимой консервативной терапии:
- Анамнестические — отягощенный акушерский анамнез, предыдущее ЗПК детям, смерть ребенка от гемолитической болезни или желтухи неизвестной этиологии;
- Клинические — желтушное окрашивание первородной смазки или пуповины, желтуха при рождении или в первые часы жизни, увеличение размеров печени, селезенки, признаки билирубиновой интоксикации;
- Гематологические — содержание общего билирубина в пуповинной крови свыше 80 мкмоль/л и более:
- у доношенных новорожденных — почасовой прирост общего билирубина более 10 мкмоль/л;
- у недоношенных новорожденных — почасовой прирост общего билирубина более 8 мкмоль/л.
Показанием к позднему ЗПК служат значения непрямого билирубина:
- Для доношенного новорожденного — 308-340 мкмоль/л;
- Для недоношенного новорожденного — критические уровни билирубина представлены в таблице.
При наличии факторов риска развития билирубиновой энцефалопатии ЗПК проводят при более низких цифрах билирубина.
К факторам риска относятся: оценка по Апгар на 5-й минуте < 3 баллов; гипопротеинемия (общий белок сыворотки крови < 50 г/л); гипогликемия (< 2,2 ммоль/л); наличие генерализованного инфекционного заболевания. При появлении первых симптомов билирубиновой интоксикации показано немедленное начало ЗПК независимо от уровня билирубина.
Показания к проведению ЗПК новорожденным:
| Масса, г | Критические значения билирубина у новорожденных разного возраста (сут), мкмоль/л | ||||
| 3 | 4 | 5 | 6 | 7 | |
| < 1000 | 137 | 171 | 171 | 171 | 171 |
| 1000-1249 | 171 | 171 | 171 | 257 | 257 |
| 1250-1499 | 205 | 257 | 257 | 257 | 257 |
| 1500-1749 | 257 | 257 | 257 | 257 | 274 |
| 1750-1999 | 257 | 274 | 274 | 291 | 291 |
| 2000-2499 | 296 | 308 | 308 | 308 | 310 |
| >2500 | 308 | 310 | 315 | 320 | 340 |
Подготовка к ОЗПК при отечной форме ГБН должна быть проведена еще до рождения ребенка; операция должна быть начата в первые 20 минут после рождения ребенка.
В течение всего процесса подготовки к ОЗПК, выполнения операции и последующего ведения ребенка необходим постоянный мониторинг витальных функций (ЧСС, ЧД, сатурация, АД, температура тела).
Донорская кровь и (или) ее компоненты при ОЗПК переливаются из расчета 160-180 мл/кг массы тела для доношенного ребенка и 170-180 мл/кг для недоношенного. Соотношение эритроцитарной массы/взвеси и свежезамороженной плазмы составляет 2:1.
При резус-конфликте вводят резус-отрицательную одногруппную с кровью ребенка эритроцитную массу и СЗП, возможно использование плазмы АВ (IV).
При изолированном групповом конфликте назначается эритроцитная масса 0 (1) группы, совпадающая по резус-фактору с резус-фактором эритроцитов ребенка, и плазма АВ (IV) или одной группы с группой крови ребенка.
При гемолитической болезни новорожденного с конфликтом по редким факторам вводят донорскую кровь, не имеющую «конфликтного» фактора.
ЗПК в тяжелых случаях можно провести 2-3 раза в течение 1-х суток, а затем на 2-е или 3-и и 4-е сутки жизни, всего 4-5 раз. ЗПК остается основным лечебным методом снижения билирубина, выведения токсичных продуктов гемолиза и антител. Количество вводимой крови составляет 150-180 мл/кг, скорость введения — 2-4 мл/мин. Кровь донора должна быть свежей, срок хранения не более 3 сут. ЗПК в первые 3-5 дней проводят через пупочную вену (метод Даймонда). В пупочную вену вводят полиэтиленовый катетер, на глубину 5-7 см. Если при правильном введении кровь из него не вытекает, то вводят 2 мл 0,25 % раствора новокаина для снятия спазма сосудов или гепарин в дозе 50-100 ЕД/кг при повышенной свертываемости. Первые порции крови собирают для определения группы крови и содержания билирубина.
Дробными порциями (по 20 мл) выводят кровь ребенка и вводят кровь донора в том же объеме. Объем одного замещения (однократного выведения крови) и одного восполнения (однократного введения компонентов крови) не должен превышать 5 мл/кг под обязательным контролем гемодинамики, дыхания и функции почек. Скорость одного замещения — 3-4 мл/мин. На 2 шприца эритроцитарной массы вводится 1 шприц свежезамороженной плазмы.
После введения каждых 100 мл крови донора вливают 2 мл 10% раствора кальция глюконата или 0,5 мл 10% раствора хлористого кальция, предварительно разведенных в 5 мл 5% раствора глюкозы с целью профилактики гипокальциемии и гипогликемии. В результате операции (с учетом крови, взятой на биохимическое исследование) суммарный объем вводимых компонентов донорской крови должен быть равен суммарному объему выведенной крови ребенка.
Перед окончанием операции осуществляется забор крови на билирубин. О безусловной эффективности ОЗПК свидетельствует более чем 2-кратное снижение билирубина к концу операции.
Операция длится не менее 2 ч, после чего обеспечивают динамическое наблюдение за содержанием билирубина (2-3 раза в сутки с определением почасового прироста).
Последствия гемолитической болезни новорожденного: осложнения ФТ и ОЗПК
При фототерапии могут возникнуть различные реакции и побочные эффекты!
Таблица «Осложнения фототерапии при гемолитической болезни новорожденного и побочные эффекты»:
| Проявления | Механизм развития | Мероприятия |
| Синдром | Индукция синтеза меланина | Наблюдение |
| Синдром | Накопление продуктов фотоокисления прямого билирубина | Отменить фототерапию |
| Диарея | Активация секреторной функции кишечника | Наблюдение |
| Лактазная | Серозные повреждения ворсинчатого эпителия | Наблюдение, при необходимости отмена фототерапии |
| Гемолиз | Повреждение циркулирующих эритроцитов в результате фотосенсибилизации | Отмена фототерапии |
| Ожоги кожи | Чрезмерное излучение лампы | Отмена фототерапии |
| Эксикоз | Повышение потери жидкости | Увеличить объем жидкости |
| Кожная сыпь | Повышение выброса гистамина при фотосенсибилизации | Наблюдение, при необходимости отмена фототерапии |
На фоне ОЗПК возможно развитие следующих осложнений:
- Со стороны сердечно-сосудистой системы: аритмия, объемная перегрузка, застойная сердечная недостаточность, остановка кровообращения.
- Гематологические: перегрузка гепарина, нейтропения, тромбо-цитопения, реакция «трансплантат против хозяина».
- Метаболические: ацидоз, гипокальциемия, гипогликемия, гипер-натриемия.
- Инфекционные: бактериальные и вирусные инфекции.
- Сосудистые: эмболии, тромбозы, некротизирующий энтероколит, портальная гипертензия, перфорация сосудов пуповины.
- Системные последствия ОЗПК при гемолитической болезни новорожденного: гипотермия.
Желчегонная терапия и прогноз гемолитической болезни новорожденного
Желчегонная терапия показана в случае развития синдрома холестаза на фоне гемолитической болезни крови детей. Проводится только препаратом урсодезоксихолевой кислоты в виде суспензии из расчета 20-30 мг/кг/сут.
Ребенка с гипербилирубинемией, обусловленной несовместимостью по АВО, целесообразно кормить грудью с рождения, поскольку антитела, содержащиеся в молоке, разрушаются соляной кислотой и ферментами пищеварительной системы. При резус-конфликте, если ребенку не проводилось заменное переливание крови, его в течение первых 10-14 дней кормят материнским пастеризованным (во время пастеризации антитела разрушаются) или донорским молоком. При проведении заменного переливания крови через 3-5 ч после операции ребенка можно приложить к груди.
Допаивание не рекомендуется детям на грудном вскармливании. Оно возможно только в том случае, когда грудного молока недостаточно чтобы увеличить суточный объем на 10-20%. Если состояние ребенка не позволяет увеличить объем жидкости энтерально, только тогда проводится инфузионная терапия.
Для предупреждения развития резус-сенсибилизации всем женщинам, имеющим резус-отрицательнную принадлежность крови, в первые 72 ч (желательно в первые сутки) после родов (при резус-положительной крови у новорожденного) или аборта следует ввести анти-D-резусный глобулин внутримышечно, 1 дозу однократно.
Наиболее неблагоприятный прогноз при отечной форме болезни крови новорожденного, смертность при которой достигает 30%. Более 90% новорожденных детей с гемолитической болезнью, своевременно получивших лечение, в том числе внутриутробную трансфузию крови, не имеют неврологических отклонений впоследствии. Развитие билирубиновой энцефалопатии определяет неблагоприятный неврологический исход. У пациентов, перенесших внутриутробную трансфузию крови по поводу ГБН, регистрируется повышение частоты нарушений слуха в 5-10 раз выше, чем в общей популяции.

 Болезни
Болезни  Педиатрия
Педиатрия Первая помощь
Первая помощь Анатомия
Анатомия Питание
Питание Препараты
Препараты